Ethik und Wissenschaft
Juli 2021 – Dringender Hinweis:
Wir möchten anmerken, dass es medizinisch keine evidenzbasierende Indikation für eine Impfung mit einem der 4 durch die Europäische Kommission zugelassenen Corona-Impfstoffe bei Kindern gibt. Kinder können zwar infiziert werden, aber bei ihnen verläuft eine Infektion aus entwicklungsphysiologischen Gründen nahezu ausschließlich still oder symptomarm.
Diese vier Impfstoffe sind zudem lediglich zum potentiellen Schutz vor schweren COVID-19-Erkrankungsverläufen zugelassen und nicht als Schutz vor dem Erreger „SARS-CoV 2“.
Hierin begründet sich auch, warum „Geimpfte“ sowohl mit dem Erreger „SARS-COV 2“ infiziert werden und auch an COVID-19 erkranken können, ebenso können „Geimpfte“ den Erreger in sich tragen und Andere damit infizieren.
Die gegenwärtig zugelassenen „Impfstoffe“ wirken nicht gegen das Virus „SARS-CoV 2“.
Unsere wissenschaftliche Covid-19-Impfkritik
Wenn Mitglieder des Deutschen Ethikrates Äußerungen vorbringen, wie wir sie Ende Dezember 2020 von Herrn Prof. Henn in Bezug auf die Corona-Impfungen vernehmen mussten – Impfkritikern empfielt er ständig ein Dokument bei sich tragen mit Inhalten wie u.a.: ‚Ich will, wenn ich krank werde, mein Intensivbett und mein Beatmungsgerät anderen überlassen‘“ (siehe: MDR-Brisant vom 21.12.2020) -, sehen wir eben diese Personen unbedingt in der Pflicht, fachliche Kritiken unmittelbar und vollständig auszuräumen.
Herr Ministerpräsident Weil ruft in Niedersachsen die Bevölkerung auf, Verstöße gegen die Corona-Maßnahmen an die Behörden zu melden (siehe: HNA vom 03.11.2020) und fordert damit indirekt, dass Menschen einander Denunzieren sollen. Auch er und seine Mitglieder der Landesregierung verweigern sich aktiv einem sachlichen Diskurs.
Prof. Henn führte u.a. an, Forscher weltweit haben mit riesigem Aufwand das Tempo erhöht, aber nicht auf Kosten der Sicherheit. Allen Impfskeptikern empfiehlt er, sich auf den Rat von „Menschen, die sich wirklich auskennen“ zu verlassen.
Die Bedenken aber liegen nicht unbedingt nur im ungewöhnlichen Tempo begründet, auch wenn man mit einer gewissen Überraschung feststellen muss, dass z.B. Ethikkommissionen nicht nur im Eiltempo (teilweise unter 3 Wochen nach initialer Einreichung) Genehmigungen für Covid-Impfstudien erteilten, sondern in diesen Fällen sogar Genehmigungen unter Bedingungen erteilt haben, dass noch über 15 Auflagen nachträglich erfüllt werden müssen. Das sind Umstände, die in anderen Fällen erst mal zu Mängelschreiben, Nachreichungen, erneuten Prüfungen führen und hier im regulären Fall ein bis zwei Monate Zeit kosten würden.
Bedenken bezüglich der Impfung resultieren aus der Tatsache, dass Kritikern bis zum jetzigen Zeitpunkt zu wenig Daten in Bezug sowohl auf Pharmakovigilanz und Pharmakokinetik vorliegen.
Pharmakokinetische Untersuchungen sind zwar bei Impfstudien nicht zwingend vorgeschrieben. Da es sich aber um ein neues Impfverfahren handelt, und hierbei eine mehrfach erhöhte Konzentration an kationischen Nanolipliden im Vergleich zu der verwendeten mRNA verabreicht wird, hätte man diese jedoch erwartet. Eine Pharmakovigilanz ist unmöglich nach einer 2 -3 monatigen Phase 3 Studie und einem nur 2 monatigen Follow Up (Nachbeobachtung) von Probanden.
Ebenso haben viele Ärzte und Wissenschaftler berechtigte Bedenken in Bezug auf das Nutzen-Risiko-Verhältnis für ein erstmalig überhaupt zur Impfung von Menschen zugelassenes Verfahren der RNA-Technik. Hinzu kommen schwerwiegende und gravierende Mängel in der veröffentlichten Studie zum Impfstoff der Firma Biontech/Pfizer (1).
Unter anderem werden hier die vor Beginn der Studie definierten „Endpoints“ nicht erfüllt, und nach genauer Definition der „Endpoints“, eine Wirksamkeit zum Schutz vor schweren Covid-19-Verläufen nicht erreicht.
Es verwundert zutiefst, wie diese Veröffentlichung ein peer-review-Verfahren durchlaufen und die wissenschaftlich eher ungesicherten Ergebnisse als Basis für eine Zulassung dienen konnten.
Es gab bisher noch nie RNA-Impfstoffe, die in der Humanmedizin zugelassen wurden. Zwar gibt es RNA-Verfahren, z.B. in der Krebsmedizin die RNA-Antisense Technology oder mRNA, jedoch liegt hier ein gänzlich anderes Risiko-Nutzen-Verhältnis vor. Die Anwendung eines Verfahrens für eine Person, bei der als Einschlusskriterium für die Therapie eine zuvor erfolgte Chemotherapie gilt, ist sicher nicht übertragbar, dass man das gleiche Verfahren in Form einer Impfung für die breite Masse der Bevölkerung durchführen könne.
Zusätzlich sind die meisten bisher verwendeten Krebsimpfstoffe eher therapeutische, als prophylaktische Impfstoffe und zielen u.a. darauf ab, zellvermittelte Reaktionen, wie z.B. CTLs (Cytotoxic T-Lymphocytes) zu stimulieren, die in der Lage sind, die Tumorbelastung zu verringern oder zu beseitigen.
Mit Befremden ist dann auch festzustellen, dass es inzwischen erste angefangene Studien zu SARS-COV-2 RNA-Impfungen bei Kindern gibt. Eine ethische Rechtfertigung hierzu ist nicht begreiflich. Warum möchte man Millionen Kinder flächendeckend mit einem völlig neuen Verfahren impfen (zu denen es keine Langzeiterfahrungen gibt), während die Covid-19-Mortalität für das pädiatrische Kollektiv mit 0,0018% extrem niedrig (22) ist.
Obgleich evidenzbasiert das Risiko für eine schwere Verlaufsform oder gar Hospitalisierung bei Kindern extrem gering ist, sind schon gegenwärtig Kinder die Bevölkerungsgruppe unserer Gesellschaft, die unter den Corona-Maßnahmen mit am stärksten zu leiden haben. Ganze Geburtskohorten von Kindern erfahren gegenwärtig unsägliche Traumata (Schulschliessungen, Einschulungsfotos mit MNB, nicht gefeierte Geburtstage und Abschlüsse, ausgefallener Sport, verpasste Vereinserfolge, eine hinter MNB emotionslos erscheinende Gesellschaft, Mangel an sozialen Kontakten und Kind-Kind-Interaktionen, …). All dies wird in Kauf genommen, obgleich nur 1 bis 3% der Covid-Fälle bei Kindern auftreten und die meisten dieser Fälle völlig asymptomatisch sind oder nur flüchtige, milde Symptome zeigen (2, 3, 4, 5, 6).
Man könnte hier viele Studien anführen, welche belegen, dass Covid-19 bei Kindern in der Regel harmlos verläuft, natürlich mit vereinzelten Berichten über Verläufe mit Komplikationen (z.B. das Auftreten des Kawasaki Syndroms). Jedoch ist inzwischen bekannt, dass bei Kindern die Expressionsrate des ACE-Rezeptors (Angiotensin-Converting-Enzyme 2/ACE2) deutlich geringer ist, mit dem das Virus an Zellen andockt und somit Kinder dem SARS-COV-2-Virus weniger Möglichkeiten für eine Infektion bieten (7).
Ebenso ist die Expressionsrate des Enzyms TMPRSS2 (Transmembrane Protease Serine Subtyp 2) verringert, welches eine Schlüsselrolle bei der Aktivierung der Spike Proteine des Virus hat (8).
Eine weitere mögliche Ursache für die geringen Infektionsraten und „harmlosen“ Infektionsverläufe bei Kindern ist die Kreuzimmunität zu anderen Corona-Viren. In einer neueren Untersuchung ging man der Frage nach, ob frühere Infektionen mit den altbekannten Corona-Viren, vor SARS-COV-2 schützen. Durch Untersuchungen an Seren aus der Zeit vor Covid-19, fand man Antikörper, die auf SARS-COV-2 reagierten. Interessanterweise lag die Prävalenz bei Kindern mit 43,8% deutlich höher als bei Erwachsenen (5,3%). Diese Kreuzimmunität scheint gegen die S2-Einheit des Spike-Protein von SARS-COV-2 gerichtet zu sein. Es ist einer der beiden Bestandteile, die das Spike-Protein benötigt, um eine Zelle zu infizieren. Mit S1 bindet das Virus an die menschliche Zelle, mit S2 wird nachfolgend das Eindringen in die Zelle ermöglicht (9).
Unabhängig von den Erkenntnissen bei Kindern, wissen wir heute aus wissenschaftlicher und medizinischer Sicht nach 10 Monaten mit COVID-19, weit mehr als noch zu Beginn dieser „Pandemie“. Auch pharmakologisch haben viele Ärzte inzwischen viel gelernt und Fortschritte gemacht.
Eine jüngere Studie zeigt beispielsweise, dass der Anteil der Todesfälle unter schwerkranken Corona-Patienten stark zurück geht, was die Autoren mit den vielen kleinen Fortschritten bei der Therapie erklären. Von 5.121 hospitalisierten Patienten in New York sank die bereinigte Sterblichkeit von 25,6% auf 7,6%. Die standardisierte Sterblichkeitsrate in New York sank von 1,26% im März 2020 auf 0,38% im August 2020 (10).
Das Problem ist eine mangelnde Informations- und Weiterbildungskompetenz, etwa im aktuell evidenzbasierten Umgang bei positiven Fällen u.a. in Pflege- und Betreuungseinrichtung, bei Hausärzten und in Krankenhäusern.
Herr Prof. Henn empfiehlt allen Impfskeptikern, sich auf den Rat von „Menschen, die sich wirklich auskennen“ zu verlassen. Daher hätten wir gerne detaillierte Antworten auf die folgenden Fragen, um die Skepsis unter Ärzten und Wissenschaftlern ausgeräumt zu wissen.
Eine Antwort, dies sei ja alles von der Zulassungsbehörde geprüft worden, reicht nicht aus!
1. Es fehlen Daten bezüglich der genauen Zusammensetzung und Verteilung des verwendeten Nano-Lipid-Carrier (Lipid Nanoparticles – LNPs) und RNA, sowie Informationen bezüglich deren Abbau/Anreicherung im Organismus. Es fehlen Angaben über die Metabolisierung und Ausscheidung. Informationen über die Verteilung in Tierdaten sind nicht zu finden, z.B. Anreicherung von Substanzen in Milz, Leber, Lymphknoten oder in den Ovarien weiblicher Tiere. Hier handelt es sich um eine fast 20-fach höhere Konzentration von verschiedenen kationischen Lipiden im Vergleich zu den 30 Mikrogramm aktiver RNA pro Dosis. Auch aus dem FDA-Prüfbericht zur Zulassung der Biontech Sars-Cov-2 Impfung sind hierzu keine Angaben zu finden, nur eine kurze Auflistung der Komponenten (LINK).
Mit Befremden ist hier festzustellen, dass hier Unternehmen wie Biontech/Pfizer oder Moderna bei der genauen Zusammensetzung des Nano-Lipid-Carriers für die mRNA, lediglich auf das Betriebsgeheimnis hinweisen, und nicht einmal teilnehmende Prüfärzte von Studien die genauen Informationen aus den Investigator Broschüren erfahren.
2. Wo sind die in Vitro und in Vivo Toxizitätsstudien mit den spezifisch verwendeten und von den Unternehmen geheim gehaltenen Nano-Lipid-Carrier (Lipid Nanoparticles LNPs) und der bei der Impfung verwendeten Impf-RNA?
Seit den Anfängen der Gentechnik weiß man, dass aufgrund der Toxizität der kationischen Lipide, die für jede Zellart jeweils optimalen Verhältnisse und Mengen an Lipiden und Nukleinsäuren für die Transfektion von Zellen ausgetestet werden. Ebenso können die kationischen Lipide proapoptotische und proinflammatorische Effekte auslösen (12).
Es gab in der Vergangenheit diverse Studien für LNPs im Tierversuch. Diese haben festgestellt, dass diese in Vitro zytotoxisch sind und in Vivo Entzündungsprozesse fördern können (13).
Ob das bei den in diesem Impfstoff verwendeten LNPs ausgeschlossen wurde, ist nicht publiziert. In der Veröffentlichung der EMA sind lediglich Angaben, dass einige (wie viele?) Hamster Dosen von 100 Mikrogramm COVID-19-mRNA-Impfung überlebt haben, ohne Hinweise auf systemische Toxizität. Diese zeigten unter anderem systemische Entzündungsreaktionen auf den Impfstoff, eine Erhöhung der Körpertemperatur, erhöhte Leukozyten- und gamma-GT- Werte und insbesondere eine erhöhte Albumin-Globulin Ratio (A/G Ratio), wie es bei Autoimmunkrankheiten vorkommt.
Ob es Toxizitätsstudien zur Feststellung einer letalen Dosis gibt, ist nicht publiziert. Auch gibt es keine Ergebnisse und/oder Grafiken dazu zu finden.
3. Wie sieht es mit Untersuchungen zur Carcinogenität und Genotoxizität in Vitro in Zellkulturen und in Vivo bei Tieren aus?
Mit Verwunderung liest man zum Risk Management Plan der EMA bei der Impfung von Biontech folgendes: „Safety pharmacology, genotoxicity and carcinogenicity studies have not been conductet, in accordance with the 2005 WHO vaccine guideline“.
Solche Untersuchungen sind zwar normalerweise nicht für Impfstudien vorgesehen, jedoch handelt es sich bei der Impfung mit RNA um einen biotechnologischen Eingriff zur Manipulation der natürlichen Translationsmechanismen in den Zellen.
Das Dogma der Molekularbiologie bei Zellen lautet, dass RNA von der DNA kopiert wird und nicht umgekehrt, es sei denn, man verfügt über Werkzeuge wie die Reverse Transkriptase – welche eben Retro-Viren besitzen. Dieses sollte daher bei einer an Millionen, gar Milliarden Menschen geplanten RNA-Impfung unbedingt überprüft sein.
Wir wissen, dass RNA unter anderem regulatorische Funktionen sowohl im Zellkern, als auch im Zytoplasma haben kann. Neben den länger bekannten mRNA, Messenger-RNA, Ribosomale-RNA, und Transfer-RNA (tRNA), erfüllen small interferring RNA (siRNA) und micro RNA (miRNA) wichtige Funktionen bei der Regulation von zellulären Prozessen. Mit Hilfe der RNA Interferenz und single guide RNA (sgRNA) bei der Genome-Editing-Methode CRISPR/Cas9 DNA können wir Bausteine im Erbgut so einfach und präzise verändern, wie es bis vor kurzem noch unvorstellbar war. Natürlich unterscheiden sich die „neuen“ RNA-Typen strukturell von der mRNA oder benötigen die Bindung an bestimmten Proteinen, jedoch ist der Einfluss der verschiedenen Formen der RNA noch nicht vollständig aufgeklärt.
Ein dogmatisch motivierter Satz „Das ist Blödsinn, es gebe auch keinen Hinweis darauf, dass die von den Körperzellen nach der Impfung aufgenommenen mRNA in DNA umgeschrieben wird“ reicht nicht aus. Daher müssen folgende Fragen auch beantwortet werden:
4. Gibt es nur „keine Hinweise“ oder liegen Daten aus Kontrollversuchen mit Zellkulturen vor, bei denen man Zellen transfiziert hat mit dem identisch verwendeten Lipid-Carrier und Plasmid Construct (inkl. clean cap, Poly A, 3‘ UTR, sowie das open frame des SARS-Cov-2 Spike Protein) und mit einem Marker (z.B. GFP) versehen hat?
5. Gibt es nur „keine Hinweise“ oder liegen Daten aus Kontrollversuchen mit Zellkulturen vor, bei denen man bei verschiedenen Zelltypen wiederholt und zu 100% auch nach mehreren Zellteilungen, diesen Marker oder das SARS-Cov-2 Spike Protein niemals nachgewiesen werden konnte?
6. Wurden solche Versuche im Rahmen einer Co-Infektion mit verschiedenen Retro- oder Adeno-Viren durchgeführt, um die Frage zu beantworten, was passieren könnte, wenn man während eines viralen Infektes geimpft wird?
7. Wurden Versuche wie In-Vitro Mammalian Cell Gene Mutations Tests durchgeführt?
8. Gab es hierzu gleiche Ergebnisse aus in Vivo Tierversuchen?
9. Gab es zytotoxische Untersuchungen, indem mit SARS-Cov-2 RNA transfizierte Zellen mit T-Zellen exponiert wurden? Falls Ja, beobachtete man hier eine zytotoxische T-Zell Aktivität gegenüber den zuvor transfizierten Zellen und ab welcher zuvor verwendeten Konzentration des Impfstoffes?
Wo sind ggf. die Übersichten und Grafiken?
10. Potentielle Bedenken gab es in der Vergangenheit auch dahingehend, dass einige mRNA-basierte Impfstoffe (14, 15) potente Typ-I-Interferon-Antworten induzieren, die nicht nur mit Entzündungen, sondern potentiell auch mit Autoimmunität (16) in Verbindung gebracht wurden.
Welche Vorkehrungen wurden etwa bei Biontech/Pfizer getroffen, um genau dies zu verhindern oder sind erste Berichte von anaphylaktischen Schocks bei Geimpften ein Anzeichen dafür, dass dieses Problem nach wie vor existiert?
Kann man anhand von etwa 18.000 Probanden, die in der Studie den Impfstoff erhielten und nur 2 Monate überwacht wurden, langfristige Autoimmunkrankheiten ausschließen?
11. Es gibt diverse Studien die zeigen, dass aufgrund einer Immunisierung mit den Spike Proteinen als Target bei Sars-CoV und MERS (die sich von dem Sars-CoV-2 Spike Protein nur geringfügig unterscheiden), es in der Vergangenheit zu schweren Formen von pulmonaler Immunpathologie nach der Exposition mit dem Virus gekommen ist (19, 20). Auch kann Exogene-RNA eine interferonvermittelte antivirale Immunantwort aktivieren, die mit Entzündungen und potenzieller Autoimmunität verbunden sind (21). Kann man anhand von ca. 18.000 Probanden die in der Impfgruppe die Impfung erhalten haben und nur 2 Monate überwacht wurde, langfristige Autoimmunkrankheiten oder schwere immunpathologische Reaktionen bei Geimpften jeglicher Art ausschließen?
Bis hierhin ist festzustellen, dass viele bedeutsame Punkte und Fragen seitens der offiziellen Quellen der FDA oder der EMA nicht beantwortet sind.
Schlimmer noch ist aber, dass nach genauer Durchsicht der Publikation zur Impfstudie von Biontech/Pfizer, gravierende Mängel feststellbar sind. Diese sind offensichtlich weder den Experten der FDA noch denen der EMA aufgefallen.
Beispiele:
In der Studie erfolgt die zweite Impfdosis 21 Tage nach der 1. Dosis. Die von der Studie definierten Ziele („End points“) sind laut Studienprotokoll (17) folgende:

Tag 7 und Tag 14 nach der zweiten Dosis sind die Stichtage für die Statistische Analyse. Diese müssten somit für die Aussage zum effektiven Schutz vor schweren Covid-19 Verläufen herangezogen werden.
Die Ergebnisse der Effektivität des Impfstoffs BNT 162b2 gegen Covid-19 sind in der folgenden Grafik dargestellt:
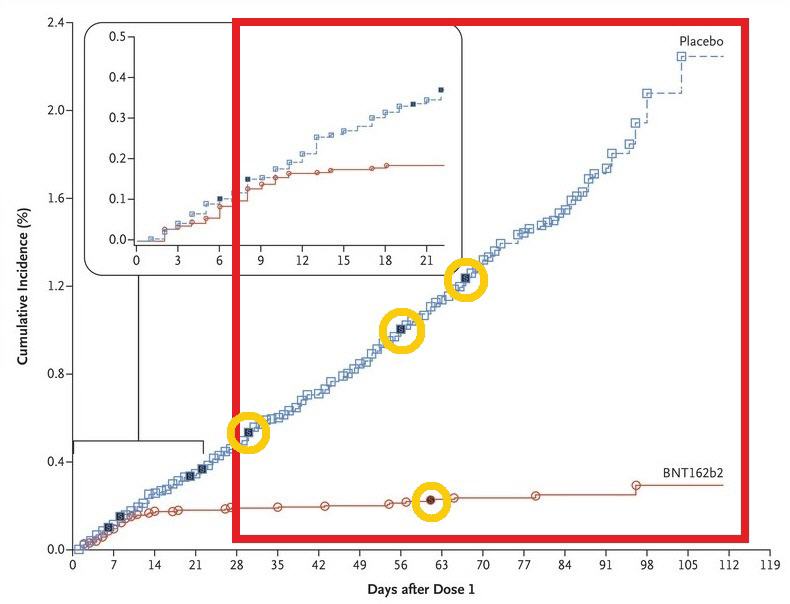
Die Tage 7 und 14 nach der zweiten Dosis entsprechen in der Grafik dem Tag 28 und 35.
Hält man sich an die maßgeblichen Zeitpunkte des Studienprotokolls, dass man ab 7 und 14 Tagen nach der zweiten Dosis prüft und auf schwere Krankheitsverläufe (ausgefüllte Punkte) untersucht, dann ergeben sich im Laufe der gesamten Studie 4 schwere Verläufe in der Placebogruppe im Vergleich zu einem schweren Verlauf in der Impfgruppe (in rot hervorgehoben).
[siehe hierzu auch Tabelle S5, in der erklärt wird, dass es 4 Fälle in der Placebogruppe gab, obwohl nur 3 Punkte angezeigt sind – „Some symbols represent more than one case, owing to overlapping dates“]
Nach einer nur 2-monatigen Beobachtungszeit von Probanden und ohne eine erfolgte Langzeitbeobachtung, impft man nun Menschen anhand einer Statistik, die sich nach korrekter Endpoint-Analyse aus einem schweren Verlauf in der Impfgruppe vs. 4 schweren Verläufen in der Placebo Kontrollgruppe zusammensetzt.
Das genau ist die Aussage zur Effektivität der Impfung und das Fazit der Studie mit 43.548 Probanden, letztlich kommt es ja darauf an, dass eine Impfung vor schweren Covid-19 Verläufen oder gar Todesfolgen schützt.
Wie also ist die „Effektivität von 95% bei ca. 40.000 Probanden errechnet worden?
Man würde erwarten, dass bei etwa 40.000 Probanden 20.000 Kontakt zu SARS-Cov-2 hatten und sie waren zu 95% geschützt im Vergleich zu 20.000 in der Placebogruppe.
Tatsächlich aber haben wir lediglich die Situation, dass bei der Impfung von 20.000 Probanden nur 3 schwere Verläufe und nicht mal ein einziger Todesfall verhindert werden konnte!
Die Effektivität der Impfung von 95% resultiert lediglich aus der Gesamtzahl, also dass von knapp 40.000 Probanden nach der zweiten Dosis 8 Probanden aus der Impfgruppe eine nachgewiesene Covid-19 Infektion hatten, während in der Placebogruppe 162 Infektionen nachgewiesen wurden.
Das klingt zwar durchaus vielversprechend, das primäre Ziel zum Schutz vor schweren Krankheitsverläufen wird hier jedoch verfehlt. Dies ist den Autoren bewusst, denn in der Übersichtstabelle erscheinen die Daten nicht nach der vorgegebenen Endpoint-Analyse definiert, sondern zum eigenen Vorteil „zusammengemischt“ dargestellt:
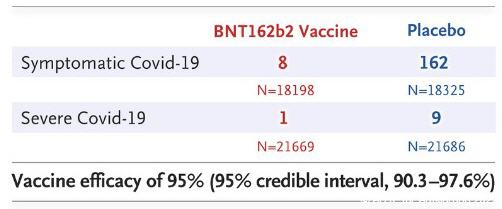
„Symptomatic Covid-19“ gibt die Daten 7+ Tage nach der zweiten Impfung an (nach der ersten Impfung wäre die „Efficacy“ 82%).
Für schwere Verläufe „Severe Covid-19“ nimmt man dagegen die Daten ab dem ersten Tag. Dies ist eine Protokollverletzung, manipulativ dargestellt und ein Skandal, dass dies offensichtlich niemandem bei den Behörden aufgefallen ist.
Die meisten schweren Erkrankungsfälle traten schon zu Begin auf und innerhalb der ersten Tage, obgleich man hier ja keinen Unterschied erwarten kann.
Stellt man die Daten in ein Verhältnis, dann ergibt sich, dass in der Placebogruppe nur 5,5% von denen die infiziert waren, überhaupt einen schweren Verlauf entwickelten (9 von 162). Ganz anders sieht dies bei der Gruppe der Geimpften aus. In dieser Gruppe haben sich zwar nur 8 infiziert, aber einer von diesen 8 hat einen schweren Erkrankungsverlauf entwickelt. Dies macht 12,5% schwere Verläufe in der Gruppe der Geimpften.
Bei derart geringen Zahlen überhaupt eine statistische Aussage generieren zu wollen, erübrigt sich.
Verwunderlich in dieser Studie ist auch eine Betrachtung der ungewöhnlich hohen Anzahl von „Lost to Follow Up“ – Probanden in der nur 2-monatigen Beobachtungszeit.
„Lost to Follow Up“ bedeutet, Probanden konnten nach dem Einschluss in die Studie nicht mehr kontaktiert werden und es liegen keine Safety-/Effektivitäts- Informationen vor, welche in die Studie mit einfließen konnten.
Dies ist hier hinsichtlich der ohnehin schon sehr geringen Anzahl an Infektionen und schweren Verläufen dramatisch, da hier ein Potential zu signifikanten Veränderungen/Fehldeutungen besteht.
Diese Information erscheint zudem nicht in der Publikation und ist nur aus dem FDA Breefing Meeting vom 10. Dezember 2020 ersichtlich (18).
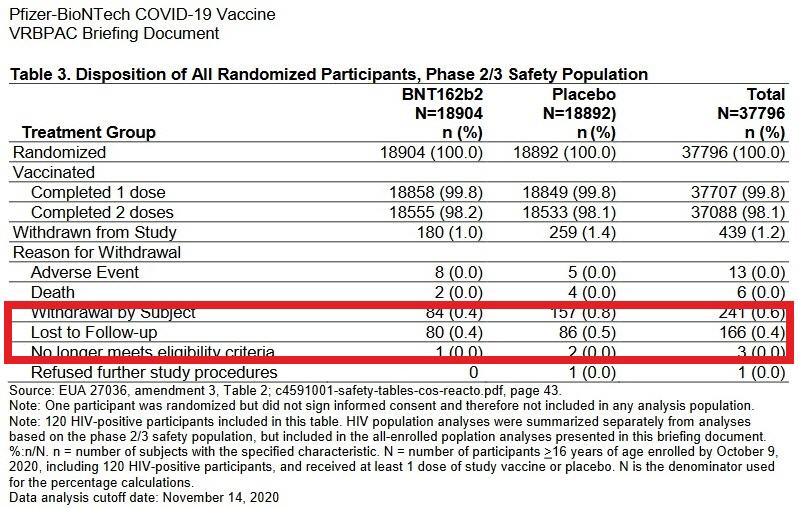
166 Probanden (80 in der Impfgruppe und 86 in der Placebogruppe) die für die Teilnahme an der Studie bezahlt werden, sind nicht zur Nachbeobachtung erschienen und konnten nicht mehr kontaktiert werden.
Ein „Lost to Follow Up“ von Patienten ist zwar insbesondere bei jahrelangen Anwendungsstudien möglich, aber dass, während einer nur 2-monatigen Beobachtung, 160 Probanden verloren gehen, während die Studie eine „sogenannte“ Statistik anhand von 4 schweren Corona-Verläufen in der Placebogruppe vs. 1 in der Impfgruppe zum Ergebnis hat, ist unglaubwürdig.
Angesichts der gravierenden Mängel, den verfehlten Endpoints der Studie zum Schutz vor schweren Verläufen, anscheinend fehlender oder nicht veröffentlichter toxikologischer, pharmakokinetischer und zytotoxischer Daten, wäre es die besondere Aufgabe eines Ethikrates daran mitzuwirken, dass insbesondere für Menschen, die sich gegen die aktuelle Impfung entscheiden, keine gesellschaftlichen Nachteile entstehen.
Wir forden Sie, Herr Prof. Henn, den Ethikrat, die Bundes- und Landesregierungen, die Gesundheitsministerien der Länder und insbesondere Herrn Bundesminister Spahn hiermit auf, diese offenen Fragen vollständig zu beantworten.
Wir werden dieses gerne auch im Sinne der allgemeinen Aufklärung und insbesondere zur Wiederzusammenführung unserer bereits sehr gespaltenen Gesellschaft diskutieren und publizieren.
Uns ist an einer evidenzbasierten Bekämpfung der Pandemie, der Gesunderhaltung und Gesundung unserer Mitbürger und der Aufrechterhaltung des gesellschaftlichen Friedens sehr gelegen.
- (1) Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Pérez Marc G, Moreira ED, Zerbini C, Bailey R, Swanson KA, Roychoudhury S, Koury K, Li P, Kalina WV, Cooper D, Frenck RW Jr, Hammitt LL, Türeci Ö, Nell H, Schaefer A, Ünal S, Tresnan DB, Mather S, Dormitzer PR, Sahin U, Jansen KU, Gruber WC; C4591001 Clinical Trial Group. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020 Dec 10:NEJMoa2034577. doi: 10.1056/NEJMoa2034577. Epub ahead of print. PMID: 33301246; PMCID: PMC7745181.
- (2) Features of 16,749 hospitalised UK patients with COVID-19 using the ISARIC WHO Clinical Characterisation Protocol: Annemarie B Docherty, Malcolm Gracie Semple et al medRxiv 2020.04.23.20076042; doi: https://doi.org/10.1101/2020.04.23.20076042
- (3) CDC COVID-19 Response Team. Coronavirus Disease 2019 in Children – United States, February 12-April 2, 2020. MMWR Morb Mortal Wkly Rep. 2020 Apr 10;69(14):422-426. doi: 10.15585/mmwr.mm6914e4. PMID: 32271728; PMCID: PMC7147903. https://pubmed.ncbi.nlm.nih.gov/32271728/
- (4) Castagnoli R, Votto M, Licari A, Brambilla I, Bruno R, Perlini S, Rovida F, Baldanti F, Marseglia GL. Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Infection in Children and Adolescents: A Systematic Review. JAMA Pediatr. 2020 Sep 1;174(9):882-889. doi: 10.1001/jamapediatrics.2020.1467. PMID: 32320004. https://pubmed.ncbi.nlm.nih.gov/32320004/
- (5) COVID-19 National Incident Room Surveillance Team. COVID-19, Australia: Epidemiology Report 13 (Reporting week to 23:59 AEST 26 April 2020). Commun Dis Intell (2018). 2020 May 1;44. doi: 10.33321/cdi.2020.44.35. PMID: 32362270. https://pubmed.ncbi.nlm.nih.gov/32362270/
- (6) Parri N, Lenge M, Buonsenso D; Coronavirus Infection in Pediatric Emergency Departments (CONFIDENCE) Research Group. Children with Covid-19 in Pediatric Emergency Departments in Italy. N Engl J Med. 2020;383(2):187-190. doi:10.1056/NEJMc2007617 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7206930/
- (7) Bunyavanich S, Do A, Vicencio A. Nasal Gene Expression of Angiotensin-Converting Enzyme 2 in Children and Adults. JAMA. 2020;323(23):2427–2429. doi:10.1001/jama.2020.8707
- (8) Saheb Sharif-Askari N, Saheb Sharif-Askari F, Alabed M, Temsah MH, Al Heialy S, Hamid Q, Halwani R. Airways Expression of SARS-CoV-2 Receptor, ACE2, and TMPRSS2 Is Lower in Children Than Adults and Increases with Smoking and COPD. Mol Ther Methods Clin Dev. 2020 May 22;18:1-6. doi: 10.1016/j.omtm.2020.05.013. PMID: 32537478; PMCID: PMC7242205.
- (9) Ng KW, Kassiotis G et al Preexisting and de novo humoral immunity to SARS-CoV-2 in humans. Science. 2020 Nov 6:eabe1107. doi: 10.1126/science.abe1107. Epub ahead of print. PMID: 33159009. https://pubmed.ncbi.nlm.nih.gov/33159009/
- (10) Leora I Horwitz, MD, MHS, Simon A Jones, PhD, Robert J Cerfolio, MD, Fritz Francois, MD, Joseph Greco, MD, Bret Rudy, MD, Christopher M Petrilli, MD, Trends in COVID-19 Risk-Adjusted Mortality Rates. J Hosp Med. Published Online First October 23, 2020. DOI: 10.12788/jhm.3552
- (11) Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Pérez Marc G, Moreira ED, Zerbini C, Bailey R, Swanson KA, Roychoudhury S, Koury K, Li P, Kalina WV, Cooper D, Frenck RW Jr, Hammitt LL, Türeci Ö, Nell H, Schaefer A, Ünal S, Tresnan DB, Mather S, Dormitzer PR, Şahin U, Jansen KU, Gruber WC; C4591001 Clinical Trial Group. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020 Dec 10:NEJMoa2034577. doi: 10.1056/NEJMoa2034577. Epub ahead of print. PMID: 33301246; PMCID: PMC7745181
- (12) Lonez C, Vandenbranden M, Ruysschaert JM. Cationic lipids activate intracellular signaling pathways. Adv Drug Deliv Rev. 2012 Dec;64(15):1749-58. doi: 10.1016/j.addr.2012.05.009. Epub 2012 May 23. PMID: 22634161.
- (13) Winter E, Dal Pizzol C, Locatelli C, Crezkynski-Pasa TB. Development and Evaluation of Lipid Nanoparticles for Drug Delivery: Study of Toxicity In, Vitro and In Vivo. J Nanosci Nanotechnol. 2016 Feb;16(2):1321-30. doi: 10.1166/jnn.2016.11667. PMID: 27433582
- (14) Edwards DK, Jasny E, Yoon H, Horscroft N, Schanen B, Geter T, Fotin-Mleczek M, Petsch B, Wittman V. Adjuvant effects of a sequence-engineered mRNA vaccine: translational profiling demonstrates similar human and murine innate response. J Transl Med. 2017 Jan 3;15(1):1. doi: 10.1186/s12967-016-1111-6. PMID: 28049494; PMCID: PMC5210268. https://www.nature.com/articles/nrd.2017.243#ref-CR5454,166,167,168
- (15) Pepini T, Pulichino AM, Carsillo T, Carlson AL, Sari-Sarraf F, Ramsauer K, Debasitis JC, Maruggi G, Otten GR, Geall AJ, Yu D, Ulmer JB, Iavarone C. Induction of an IFN-Mediated Antiviral Response by a Self-Amplifying RNA Vaccine: Implications for Vaccine Design. J Immunol. 2017 May 15;198(10):4012-4024. doi: 10.4049/jimmunol.1601877. Epub 2017 Apr 17. PMID: 28416600; PMCID: PMC5421303.
- (16) Theofilopoulos AN, Baccala R, Beutler B, Kono DH. Type I interferons (alpha/beta) in immunity and autoimmunity. Annu Rev Immunol. 2005;23:307-36. doi: 10.1146/annurev.immunol.23.021704.115843. PMID: 15771573.
- (17) https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7745181/#ap2
- (18) https://www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/covid-19-vaccines
- (19) Agrawal AS, Tao X, Algaissi A, Garron T, Narayanan K, Peng BH, Couch RB, Tseng CT. Immunization with inactivated Middle East Respiratory Syndrome coronavirus vaccine leads to lung immunopathology on challenge with live virus. Hum Vaccin Immunother. 2016 Sep;12(9):2351-6. doi: 10.1080/21645515.2016.1177688. Epub 2016 Jun 7. PMID: 27269431; PMCID: PMC5027702.
- (20) Tseng CT, Sbrana E, Iwata-Yoshikawa N, Newman PC, Garron T, Atmar RL, Peters CJ, Couch RB. Immunization with SARS coronavirus vaccines leads to pulmonary immunopathology on challenge with the SARS virus. PLoS One. 2012;7(4):e35421. doi: 10.1371/journal.pone.0035421. Epub 2012 Apr 20. Erratum in: PLoS One. 2012;7(8). doi:10.1371/annotation/2965cfae-b77d-4014-8b7b-236e01a35492. PMID: 22536382; PMCID: PMC3335060.
- (21) Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines—a new era in vaccinology. Nat Rev Drug Discov. 2018;17(4):261–79.
- (22) https://gth-online.org/wp-content/uploads/2020/11/113-001l_S1_Intensivmedizinische-Therapie-von-Patienten-mit-COVID-19_2020-07.pdf
- (23) https://www.bmj.com/content/362/bmj.k3948
- (24) https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Steckbrief.html
- (25) https://de.statista.com/statistik/daten/studie/1104173/umfrage/todesfaelle-aufgrund-des-coronavirus-in-deutschland-nach-geschlecht/
- (26) https://www.fda.gov/media/144245/download
Diese Forderung in ausführlicherer Form wurde bereits direkt an Herrn Prof. Henn gesendet.
(07.01.2021 – DCM/tho – Update 25.09.2021)
